Псевдовирус участвует в клик-реакции
Исследователи из Германии создали вирус везикулярного стоматита для моделирования коронавируса SARS-CoV-2 и других патогенов, который можно метить с помощью клик-химии. Частицы псевдовируса несут S-белок SARS-CoV-2, содержащий неканоническую аминокислоту, а она вступает в клик-реакцию с флуоресцентным красителем. Это позволило визуализировать большее количество молекул белка по сравнению с методами иммунохимии и наблюдать инфицирование вирусом живых клеток, в том числе визуализировать процесс инфекции в трех измерениях.

ACS Nano. 2023 DOI: 10.1021/acsnano.3c07767 | CC BY-NC-ND 4.0 DEED
Сотрудники Вюрцбургского университета (Германия) получили флуоресцирующий инфекционный вирус везикулярного стоматита с помощью инновационного подхода, сочетающего расширение генетического кода (GCE — genetic code expansion, в данном случае использование стоп-кодона TAG для кодирования неканонической аминокислоты) и методы клик-химии. Вирусные частицы, которые авторы назвали clikVSV, позволяют исследовать детальнее исследовать взаимодействия вируса и клетки.
С высокопатогенными вирусами можно работать только в лабораториях 1-2 класса биобезопасности. Для исследований в лабораториях 3-4 класса создают псевдотипированные вирусы, или псевдовирусы — безвредные вирусы, несущие на поверхности оболочечные белки патогена (например, спайк-белок коронавируса SARS-CoV-2). Можно изучать взаимодействие псевдовирусов с клеточными рецепторами и то, насколько успешно антитела против патогена препятствуют этому взаимодействию. Псевдовирусы часто конструируют на основе VSV; например, заменяют в его геноме ген поверхностного белка G на ген eGFP (VSVΔG-eGFP); клетки, инфицированные таким песевдовирусом, экспрессируют флуоресцентный белок EGFP, что удобно для микроскопических исследований.
Однако флуоресцентное мечение структурных белков так или иначе изменяет свойства псевдовирусов, поэтому растет интерес к минимально инвазивным методам. Одним из подходов может быть GCE — встраивание в белок неканонической, то есть не встречающейся в природе аминокислоты (uAA). В настоящее время известно более 200 таких неканонических аминокислот.
Чтобы получить белок, содержащий uAA, стоп-кодон TAG вводят в определенную позицию гена-мишени. При этом в клетках-мишенях, которые будут инфицированы вирусом, должны присутствовать тРНК, которая распознает кодон TAG и доставляет uAA в рибосомный комплекс, а также соответствующая тРНК-синтетаза. Эти тРНК и тРНК-синтетазу называют ортогональными, то есть не взаимодействующими с естественными компонентами клетки (подробнее об ортогональных реакциях в биосистемах см. нобелевскую лекцию Каролин Бертоцци). Благодаря им, когда рибосома встречает стоп-кодон TAG, вместо терминации трансляции происходит встраивание заданной аминокислоты. А эта аминокислота, в свою очередь, может участвовать в клик-реакции.
Термин «клик-реакции» предложил в 2001 году Барри Шарплесс (получивший за работы в этой области свою вторую Нобелевскую премию) для обозначения высокоспецифичных реакций, которые протекают быстро, с высоким выходом, без образования побочных продуктов и, как правило, объединяют небольшие модельные элементы в более сложную молекулу. Эти реакции применяют при синтезе органических молекул и макромолекул, а также в биомедицинских исследованиях.
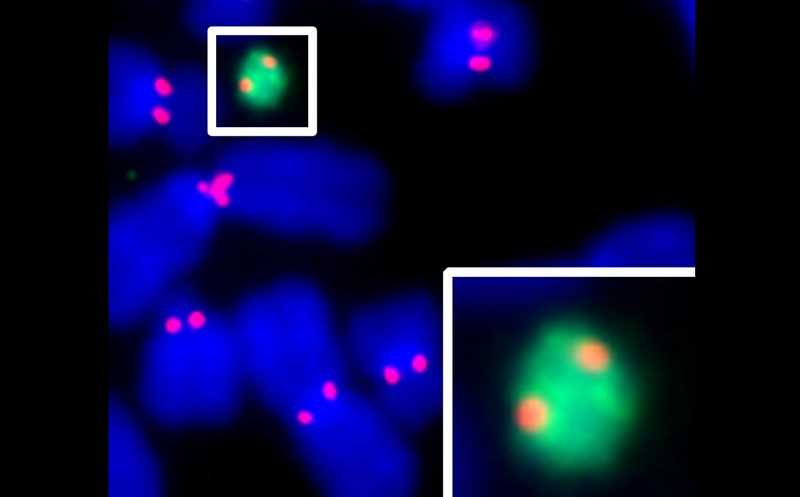
В данном случае участником клик-реакции была неканоническая аминокислота S-белка SARS-CoV-2, которым был псевдотипирован VSV. Неканоническую аминокислоту вставили в субдомен S1, где она не мешает связыванию с рецептором и иммуномечению с помощью антител. S-белок образует тримеры на поверхности вирусной частицы, так что каждый тример содержал три uAA. Авторы испытали различные варианты модифицированного белка, и наиболее удачной оказалась замена лизина в положении 567 (K567TAG) на лизин, несущий группу TCO. С этой группой взаимодействовал тетразинсодержащий краситель (Tet-Cy5 и Tet-ATTO643). Таким образом, был создан псевдовирус VSVΔG-eGFP-SARS-CoV-2-Sclick (clickVSV) — он не только индуцирует синтез зеленого флуоресцентного белка внутри инфицированной клетки, но и сам может быть помечен по коронавирусному белку.
Инфекционность конструкции оценивали на культуре клеток Vero 6. Клик-вирусы эффективно связывались с клеткой-мишенью и проникали в нее, а также вызывали экспрессию флюоресцентного белка. После мечения красителями для визуализации uAA инфекционность осталась неизменной. Реакции нейтрализации успешно были проведены как с «обычным» псевдовирусом VSVΔG-eGFP-SARS-CoV-2, так и с clickVSV. Следовательно, он может использоваться в качестве модельной системы для изучения ингибиторов и нейтрализующих агентов SARS-CoV-2.
Количество молекул S-белка, обнаруженных с помощью клик-мечения, было примерно вдвое выше по сравнению с классическим иммуномечением. Более того, этот подход позволяет исследовать вирусную инфекцию как в фиксированных, так и в живых клетках. Решетчатая световая микроскопия дает возможность визуализировать заражение клеток clikVSV в трехмерном пространстве (видео). Авторы подчеркивают, что предложенная технология проста, эффективна, экономически выгодна и может быть легко адаптирована для других вирусных поверхностных белков.
Димеры ванкомицина меняют форму и подавляют рост резистентных к ванкомицину бактерий
Источник
Jungblut M., et al. Re-Engineered Pseudoviruses for Precise and Robust 3D Mapping of Viral Infection // ACS Nano. 2023 Nov 1. DOI: 10.1021/acsnano.3c07767








 Меню
Меню





 Все темы
Все темы





 0
0