Молекулярный профиль опухолей мочевыводящих путей не меняется при метастазировании
Американские ученые сравнили геномные, транскриптомные и иммунные характеристики первичных опухолей и метастазов при уротелиальной карциноме верхних мочевыводящих путей. Молекулярный, но не геномный профиль первичных и вторичных новообразований одного и того же пациента оставался неизменным — это подтверждает обоснованность анализа образцов первичной опухоли для лечения метастазов с учетом молекулярных подтипов. В большинстве образцов выявили недостаток Т-лимфоцитов, а также дополнительную популяцию иммуносупрессивных миелоидных клеток.
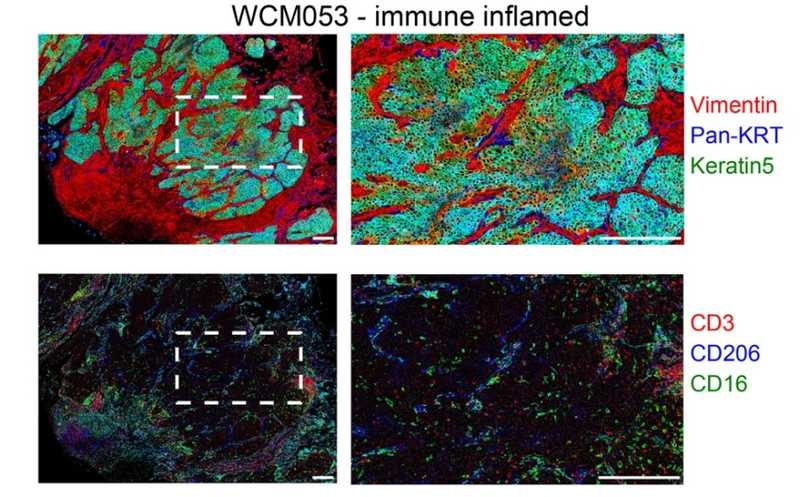
Данные визуализирующей масс-цитометрии одного из подтипов опухоли, обогащенного иммунными клетками.
Credit:
Nature Communications, 2024. DOI:
10.1038/s41467-024-46320-w |
CC BY
Появление метастазов при уротелиальной карциноме верхних мочевыводящих путей (УКВМП), которая поражает почечные лоханки и мочеточники, сильно ухудшает прогноз для пациента. Так, если опухоль не затрагивает мышечный слой ВМП, свыше 90% пациентов способны преодолеть порог выживаемости в 5 лет с момента постановки диагноза. В то же время, появление вторичных очагов в отдаленных органах в результате метастазирования снижает эту долю до 10%.
Ранее ученые из Медицинского колледжа Вейла—Корнелла (Weill Cornell Medicine) проанализировали геномный ландшафт первичных опухолей при УКВМП, а в настоящей работе сосредоточились на молекулярных характеристиках вторичных и сравнили результаты работ для понимания эволюции рака. Они изучили 44 образца опухолей от 28 пациентов с УКВМП при помощи методов полноэкзомного секвенирования, секвенирования РНК и визуализирующей масс-цитометрии на уровне единичных клеток.
ДНК клеток метастазов содержала несинонимичные мутации и вариации числа копий. Чаще всего изменениям подвергались последовательности генов Tp53, Kmt2d, Arid1a и Cdkn2a. Кроме того, во вторичных опухолях значительно чаще встречалась амплификация гена Raf1.
Для семи пациентов авторы работы составили наборы соответствующих первичных и вторичных опухолевых тканей, что позволило оценить степень разнородности новообразований у отдельного пациента. Доля общих для первичного и вторичного очага несинонимичных мутаций одного и того же человека была невелика — 17,6%. Причем сходство в генетической изменчивости опухолей было ниже у пациентов, получивших курс химиотерапии. Авторы работы предположили, что химиотерапия могла вызвать некоторые из мутаций в опухолевых клетках.
На основании паттернов экспрессии генов ученые идентифицировали два молекулярных подтипа среди первичных опухолей и четыре — среди метастазов. В отличие от геномных, молекулярные характеристики опухолей оказались стабильными: во вторичных опухолях были активны те же генетические сигнатуры, что и в первичных, в том числе ассоциированные с иммунитетом гены.
Исследователи также проанализировали иммунный контекст опухолей, разделив их на «иммунно-обедненные» (immune-depleted) и «иммунно-воспаленные» (immune-inflamed) с дефицитом и достаточным количеством Т-клеток. Большинство первичных и вторичных опухолей относились к «иммунно-обедненным», что согласовывалось с предыдущей работой по изучению первичных опухолей.
Предсказания относительно профиля микроокружения опухолей подтвердили в ходе экспериментов с использованием визуализирующей масс-цитометрии. Этот метод использует для детекции клеточных белков антитела, конъюгированные с лантаноидами. Помимо подтверждения полученных данных, авторы выделили дополнительную популяцию клеток, помимо ассоциированных с опухолью макрофагов, Т-клеток и фибробластов. Исследователи обозначили ее как группу иммуносупрессивных миелоидных клеток ввиду наличия маркера PD-L1, что дополнительно подтверждалось ее широкой встречаемостью в «иммунно-обедненных» опухолях. Авторы предположили, что обнаруженная популяция могла принадлежать к дендритным клеткам или гранулоцитам, в частности, нейтрофилам, поскольку клетки несли маркеры CD11c и CD11b, а также гранзим В.
По мнению исследователей, полученные результаты имеют важное клиническое значение. Часто невозможно получить достаточное для биопсии количество метастатической ткани, и знание о стабильности молекулярных характеристик делает обоснованным анализ первичных опухолей и подбор дальнейшего лечения. Комплексный геномный, транскриптомный и анализ иммунного фенотипа новообразований может ускорить разработку эффективной таргетной и иммунотерапии для пациентов с метастазирующей стадией рака МВП.Выявлены механизмы резистентности рака мочевого пузыря к иммунотерапии
Источник
Ohara K., et al. The evolution of metastatic upper tract urothelial carcinoma through genomictranscriptomic and single-cell protein markers analysis. // Nature Communications, 2024, published 18 March 2024. DOI: 10.1038/s41467-024-46320-w








 Меню
Меню





 Все темы
Все темы





 0
0